2017年3月2日,国际著名期刊The Journal of Experimental Medicine(实验医学杂志)发表了舒红兵研究组在抗RNA病毒天然免疫调控领域的最新研究成果。该论文题为Innate immunity to RNA virus is regulated by temporal and reversible sumoylation of RIG-I and MDA5(RIG-I和MDA5的苏素化修饰调控机体抗RNA病毒天然免疫反应)。论文的研究工作主要由舒红兵研究组的博士后胡明明和杨清、以及廖晨阳等博士生完成,舒红兵是该篇论文的责任作者。该研究在国家重大科学研究计划、国家自然科学基金创新研究群体和重点项目的资助下完成。
感染人类的病毒大致分为RNA病毒(如流感病毒、SARS病毒、埃博拉病毒等)和DNA病毒(如疱疹病毒、肝炎病毒等)。这些病毒感染机体后,机体会很快启动清除病毒的免疫反应。另一方面,这些免疫反应在启动后,会很快被调控和终止,避免过度的免疫反应引起组织损伤和死亡。抗病毒免疫反应如何受到严密精细的调控是过去10多年生物医学领域的研究热点。舒红兵研究组在过去10余年的研究中,发现了介导抗RNA病毒和DNA病毒的关键信号蛋白VISA/MAVS和MITA/STING,引领了这个热点领域的发展。2016年9月,舒红兵研究组发现苏素连接酶TRIM38和去苏素酶SENP2分别通过催化MITA发生苏素化修饰和去苏素化,调控机体抗DNA病毒天然免疫反应的开启和关闭,揭示了机体抗DNA病毒免疫的重要调控机制,相关论文发表在国际免疫学顶尖期刊Immunity。
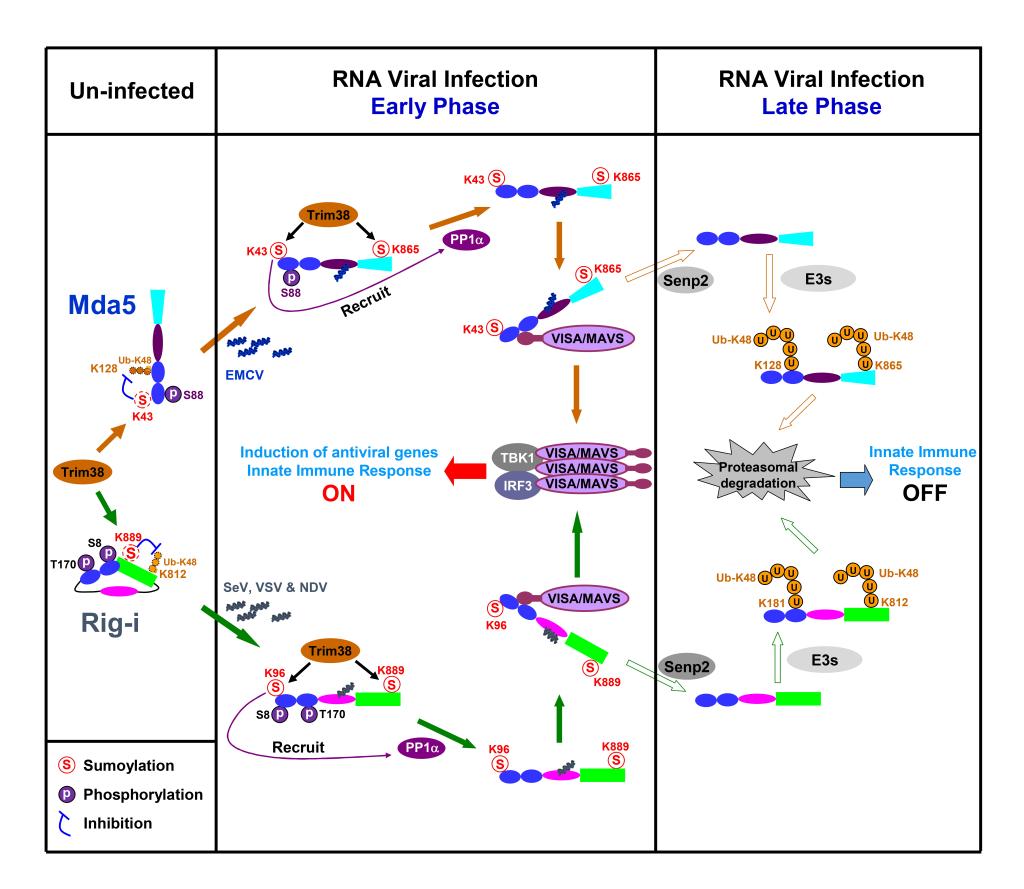
在最新的这项研究中,舒红兵研究组进一步发现苏素连接酶TRIM38也能够催化RNA病毒核酸受体RIG-I和MDA5发生苏素化修饰,而该修饰一方面调控了RIG-I和MDA5的蛋白稳定性,另一方面调控了病毒感染起始阶段RIG-I和MDA5的去磷酸化过程,从而促进RIG-I和MDA5的活化。另外,研究组还发现在病毒感染的晚期,RIG-I和MDA5的苏素化修饰被去苏素酶SENP2移除,导致它们通过蛋白酶体途径发生降解,从而终止宿主细胞的抗病毒天然免疫反应,避免因为过度免疫反应造成机体的组织损伤和严重的炎症反应。该项研究成果表明抗RNA病毒和DNA病毒免疫调控机制具有相似规律。
舒红兵研究组近年来对抗病毒天然免疫中关键的接头蛋白的翻译后修饰包括苏素化、泛素化和磷酸化等进行了广泛研究,这些研究揭示了蛋白翻译后修饰在抗病毒天然免疫动态过程中的精细调节作用和机制,为病毒感染引发的相关疾病以及自身免疫疾病等的防治提供了线索和潜在的分子靶标。