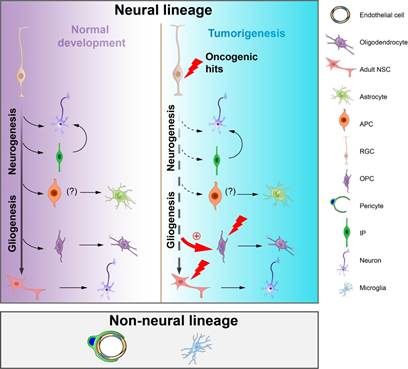
在肿瘤获得血液供应的几种方式中,肿瘤细胞转分化为血管细胞是受到密切关注的研究领域之一。多形性胶质母细胞瘤(Glioblastoma multiforme,GBM)是最为多发的成人颅内恶性肿瘤,具有侵袭性强、异质性高、血供丰富、易复发等特征。即使结合放、化疗,病人的中位存活时间也不超过15个月。GBM中包含多种恶性肿瘤细胞和正常基质细胞,其中血管的细胞组分主要包括内皮细胞和包绕内皮、具有平滑肌特征的壁细胞(mural cell)。起源于神经干/祖细胞的GBM肿瘤细胞能否跨谱系转分化为血管的细胞组分以支持GBM发生发展目前仍有争议。2010年前后,多篇研究论文认为GBM肿瘤细胞能转分化为血管内皮细胞促进肿瘤的生长,而且GBM血管内皮细胞的基因组具有GBM肿瘤细胞的常见突变。而后续的数篇研究论文则发现GBM的肿瘤细胞并不能转分化为血管内皮细胞,但产生了包绕血管内皮的壁细胞,以支持肿瘤的生长;且认为GBM肿瘤部位中约70%的血管壁细胞均起源于恶性肿瘤细胞。作为Reproducibility Project: Cancer Biology计划的一部分,复制实验的研究者未能完成GBM细胞转分化产生内皮细胞的研究。
近日,武汉大学/中南医院医学研究院周严课题组在Protein & Cell发表了题为“Resolving the lineage relationship between malignant cells and vascular cells in glioblastomas”的研究论文。该研究结合遗传学谱系追踪和基于单细胞测序数据的基因组变异特征,分析了GBM肿瘤细胞与非神经谱系细胞(包括血管壁细胞、血管内皮细胞、肿瘤相关巨噬细胞)之间的细胞谱系关系。该研究应用piggyBac转座子系统和基因编辑技术,在神经干祖细胞中引入了GBM的常见突变,构建了两种可以持续示踪肿瘤细胞命运的小鼠GBM模型,这两种GBM肿瘤模型模拟了人GBM的病理、细胞和分子特征,但具有不同的血管密度和血管构象。随后作者将这两种原位成GBM的方法分别运用到三种遗传学标记血管壁细胞和血管内皮细胞的小鼠中。采用不同颜色的荧光蛋白分别标记肿瘤细胞和血管细胞,在小鼠原发和移植GBM中开展谱系追踪(lineage tracing),均未检测到GBM肿瘤细胞转分化为血管细胞和小胶质细胞的证据。值得关注的是,在GBM的发生发展过程中,少量肿瘤细胞会混乱表达内皮细胞和壁细胞的分子标记物。这种现象可能是导致早期研究者认为GBM肿瘤细胞存在跨谱系转分化现象的一个重要因素。
作者接着应用单细胞转录组测序成功分析了小鼠和患者GBM标本血管类群细胞的染色体拷贝数变异(copy number variation,CNV)特征,并与肿瘤细胞的CNV特征开展了比较。发现血管细胞的CNV特征与肿瘤细胞大相径庭;而且CNV的分层聚类分析(inferCNV)和copyKAT分析把几乎所有的血管内皮细胞和壁细胞都定义为二倍体非肿瘤细胞。单细胞转录组分析同样发现部分GBM肿瘤细胞能混乱表达血管类群细胞的分子标记物。染色分析发现大约6-10%的GBM血管细胞处于增殖状态,而CNV特征分析也显示GBM的血管细胞发生了克隆样扩增。
虽然肿瘤细胞转分化是肿瘤演化和治疗抵抗的重要原因,但本研究通过谱系追踪和单细胞测序分析,认为起源于神经干/前体细胞的GBM肿瘤细胞仍维持了神经谱系限制性,不太可能跨谱系转分化形成非神经谱系细胞。后续研究应富集更多GBM的血管细胞,通过CNV分析判断转分化的几率;也建议采用条形码和基因编辑介导的谱系示踪研究小鼠GBM模型中肿瘤细胞转分化的可能。总之,该研究加深了对于GBM细胞谱系关系的认识,并为靶向治疗提供了线索。
博士研究生王方宇和刘煊为该论文的共同第一作者,武汉大学中南医院神经外科李志强教授和医学研究院刘颖博士为共同通讯作者。加州大学圣迭戈分校的Sylvia Evans教授亦做出了重要贡献。该项研究依托于教育部免疫与代谢前沿科学中心,受到国家自然科学基金和科技部重点研发计划的资助。
原文链接:https://academic.oup.com/proteincell/advance-article/doi/10.1093/procel/pwac006/6587399